Existen diferentes métodos para ordenar los electrones, pero antes de aprender de la manera mas sencilla es necesario tener en cuanta las siguientes recomendaciones.
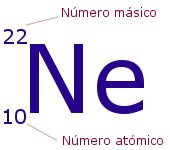
1). El numero atómico siempre indica el numero de electrones para cada elemento. (el numero atómico se refiere a la cantidad de portones que hay en el núcleo de un átomo)
2). Existe un numero máximo de electrones en cada subnivel.
s = 2 e-
p = 6 e-
d = 10 e-
f = 14 e-
Una forma practica de realizar la configuración electrónica es siguiendo los siguientes principios:
El principio de Exclusión de Pauli.
Establece que no es posible que dos electrones de un átomo tengan los mismos números cuánticos. Solo 2 electrones pueden coexistir en el en el mismo orbital atómico, y deben tener espines opuestos.
Para el átomo de helio existen 3 formas en la que se pueden colocar sus electrones en el orbital 1s:
Los diagramas a y b son imposibles por principio de Exclusión de Pauli. En el diagrama a, ambos electrones tienen el espín hacia arriba. De igual manera b tienen el espín en la misma dirección. Por tanto el átomo He tienen la configuración del caso c
En el siguiente enlace se muestra un vídeo sobre El principio de Exclusión de Pauli.
Dale clic a la siguiente imagen y te dirigirá a una pagina web, que te llevara a conocer mas acerca de este principio.




No hay comentarios:
Publicar un comentario